Research Activity
研究紹介基礎研究グループ
- 2021.06.1 |
1) 長寿遺伝子であるサーチュインの一員、Sirt7 の心血管病態における役割解明
高齢化が進行する我が国において、高齢者の健康増進や予防医学の重要性は大きくなっています。心血管疾患は老化と密接な関係にあり、寿命の短縮やQOLの低下を引き起こす主要な原因疾患となっています。従って、心血管病に老化の面からアプローチし、その機序を分子レベルで明らかにすることは、新しい治療標的の同定・開発につながると考えられます。
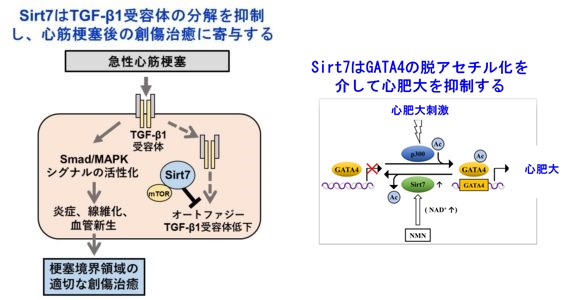
サーチュインはもともと老化を制御する分子として同定されましたが、その後の研究で細胞の分化・増殖・代謝など様々な機能を制御することがわかってきました。哺乳類ではSirt1からSirt7までのホモログが報告されています。Sirt7はもっとも新しく同定されたサーチュインですが、心血管病態における役割は分かっていませんでした。われわれはこれまでSirt7ノックアウトマウスを使用し、心血管病態におけるSirt7の機能解析を推進し、2015年にSirt7が心筋梗塞後の創傷治癒に必須の分子であることをCirculation誌に報告しました。また2019年には、圧負荷による心肥大をSirt7がGATA4を介して抑制していることをHypertension誌に報告しています。また2021年にはSirt7が血管平滑筋の増殖を制御していることを血管内皮障害モデルを用いて証明しCirculation Journal誌に報告しております。現在、Sirt7の動脈硬化病変形成や虚血還流障害における役割を検討しており、本プロジェクトにより得られた成果から、Sirt7の活性制御が心血管疾患の新たな治療戦略となりうることを提唱したいと考えています。
本プロジェクトに関係する代表的な論文
Araki, Izumiya et al. Circulation. 2015;132:1081-1093
Yamamura, Izumiya et al. Hypertension. 2020;75:98–108
Kimura, Izumiya et al. Circ J. 2021 doi: 10.1253/circj.CJ-20-0936.
2)プロテインキナーゼG (PKG1α)を標的とした応用研究
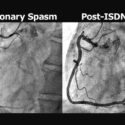
従来の標準的な薬物治療と比べ優越性が示されたPARADIGM-HF試験により、細胞内二次伝達物質のサイクリックGMPを介す心不全治療が注目を集めています。PKG1αは、サイクリックGMPの細胞内シグナル伝達を介在している中心的なリン酸化酵素であり、活性化により病的肥大や心不全の進展を抑制することが基礎と臨床研究の両面で明らかになっています。しかし、このような治療有用性に関わらず、既存の承認薬は、サイクリックGMPの生成を促すか分解を抑制することにより、間接的にPKGの活性レベルを増加させる薬理手法に限られ、PKGを直接標的とした薬剤は開発されていません。中村らは、米国ジョンズ・ホプキンス大学や英国キングス・カレッジ・ロンドンとの共同研究により、チオール基の酸化修飾を介す制御機構を心血管で見出し、活性レベルとは独立したPKG1αの機能変化を報告しました。この報告に端を発し、PKG1αレドックス制御機構はホスホジエステラーゼ5阻害薬の薬理応答に係る重要な修飾因子であることがわかり、またPKG/TSC2/mTORC1を介す病的肥大抑制の新たな分子機構の解明につながりました(図)。
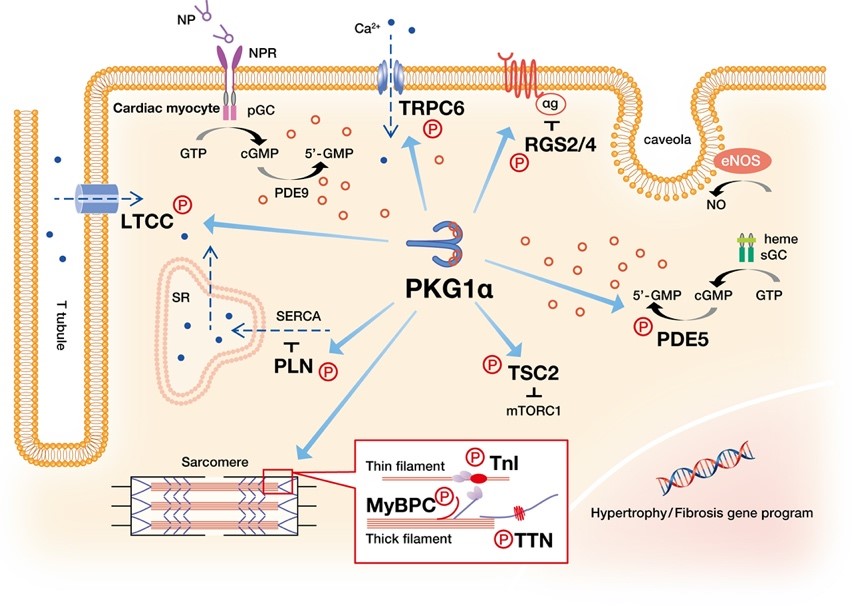
当グループでは、網羅的なリン酸化プロテオーム解析により、独自に同定したPKGリン酸化基質の表現型解析と基質反応性に関わる研究を、高血圧や圧負荷誘導性心肥大、HFpEFなどの様々な病態モデルマウスを用いて推し進めています。また、中村らの研究により、従来の活性増加に頼る戦略ではなく、酸化型PKGの立体構造変化を特異的に捕捉する重要性が明らかになってきました。そのため、熊本大学工学部との医工連携により、核酸アプタマーの同定開発とレドックス制御性のPKG捕捉に積極的に取り組んでおり、酸化型PKGを標的としたバイオマーカーの確立と核酸創薬への転用を目指しています。また、医療情報経営企画部との共同研究により、センサー情報を用いた心不全の病期予測にも取り組んでおり、PKG1αを標的とした新たな治療戦略の創出と高精度医療の実現を目指しています。
本プロジェクトに関係する代表的な論文
Nakamura T, et al, J Cardiol. 2021
Oeing CU, et al, Circ Res. 2020
Ranek MJ, et al, Nature. 2019
Nakamura T. et al, Circ Heart Fail. 2018
Nakamura T. et al, J Clin Invest. 2015
3) 胎児・新生児期の環境が成人後の循環器疾患に及ぼす栄養の解明
今世界で生まれる子供の16%は、出生児体重2,500g未満の低出生体重時です(UNICEF世界子供白書2016より)。日本でも低出生体重児の出生率は年々上昇する傾向にあり、現在日本で生まれる子供のおよそ1割が低出生体重児です(図:厚生労働省 人口動態統計より)。日本では周産期医療の進歩により、このようにして生まれた子供たちの大部分は成人へと成長することができますが、生まれた時の環境が、成人後の循環器疾患の発症に影響することはあまり知られていません。 1986年にバーカー博士らは、出生児体重が低いと成人後の心疾患リスクが高くなることを発見し(Barker Lancet 1986)、現在この概念は発展してDevelopmental Origin of Health and Disease (DOHaD)学説として認知されています。主に疫学的検討により明らかとなった本概念ですが、なぜリスクが上昇するのか?という機序については明らかではありません。 われわれはこれまでに、心臓が複数の細胞群が集まる“細胞のるつぼ”で、それらの細胞群が複雑な相互作用により心臓という臓器をつくることを報告しています。本プロジェクトでは、これまでの心臓がいかにして作られるか?という問いを基本として、胎児期・新生児期の環境が変化することによりどのように心臓は変化し、成人後の循環器疾患と関連するのかを明らかにすることを目指します。
本プロジェクトに関係する代表的な論文
Kim, Arima et al., Mechanism of Development. 2013;130:553-66.
Arima et al., Nature Communications 2012;3, 1267
4) 新規線維化関連因子を介した線維化の活動性制御と心不全進展との関連
左室収縮低下の有無に関わらず、心不全の病態進行には進行性の線維化が重要な役割を果たすことが知られています。我々は活性化型の線維芽細胞に特異的に発現するタンパクであるhuman epididymis protein 4(HE4)に着目し、心臓組織における線維化進展への関与やそのメカニズムについて研究を進めています。さらにその特徴を活かし、心不全患者における“線維化活動性”の指標としての臨床応用についても検討を行っています。これまでの研究にて、HE4の血中濃度がDCM患者さんの将来の左室リモデリングの程度を反映すること、HFrEFの病態において腎臓でのHE4発現が増加すること、HE4は液性因子として心臓線維芽細胞へ直接作用し線維化を促進すること、などを確認しております。今後は同様に線維化が重要な役割を果たすHFpEFへの応用などを進めていく予定です。将来的には、線維化活動性を指標とした新たな心不全治療法の確立や、新規の創薬ターゲットにつながるものと考えています。
本プロジェクトに関係する代表的な論文
Yamamoto, Hanatani, et al. J Am Heart Assoc. 2021.
基礎研究グループメンバー
松下 健一 特任教授
中村 太志 准教授(医療情報経営企画部)
荒木 智 助教
有馬勇一郎 特任准教授(IRCMS)
花谷 信介 助教
山本 正啓 特定研究員
徳永 信行 医員
山田 敏寛 大学院4年
九山 直人 大学院3年
中嶋 直也 大学院2年
緒方 文彦 大学院1年